
疟疾最严重的症状与疟疾寄生虫的感染有关,恶性疟原虫,病征包括严重贫血、急性呼吸道疾病和脑型疟疾. 后者的特点是受感染的红细胞(IRBC)滞留在大脑微循环中,导致血管阻塞、炎症和脑肿胀,从而导致脑干突出,导致呼吸衰竭和死亡。
这种隔离是因为感染这种疟原虫的红细胞可以粘附在大脑血管内皮表面表达的两种分子上,即细胞间粘附分子-1(ICAM-1)和内皮蛋白C受体(EPCR)。
在红细胞感染后期,恶性疟原虫产生一种蛋白质,红细胞膜蛋白1(PfEMP1),输出到IRBC表面并作为配体与一个或两个受体结合。
PfEMP1
这是一个蛋白质家族,由一组约60个被称为var基因的基因编码,帮助寄生虫逃避免疫系统(参见Will Hamilton的优秀研究报告)YouTube视频解释这一点)。表达PfEMP1蛋白亚群的寄生虫,a组+厘米,与脑型疟疾有关。
A组+厘米PfEMP1蛋白作为ICAM-1和EPCR受体的配体,促进IRBC的结合。他们有着高度的影响力保守基序在其ICAM-1结合域中,DBLβ结构域不存在于其他PFEMP1组中,仅与一个或另一个受体结合。
但是为什么与两个受体结合,而不仅仅是一个受体,会导致脑疟疾的严重症状呢?
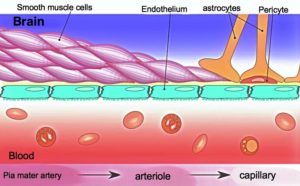
为了研究A组之间的关联机制+厘米PFEMP1,IRBCs和脑疟疾的隔离,Yvonne Adams,Anja Jenson和他的同事在哥本哈根大学和其他地方,已经使用了一个模型血脑屏障这引起了一些令人惊讶的发现。
结合分析
他们的工作,,发表在《实验医学杂志》上,解释了他们如何培育感染了表达A组寄生虫的红细胞+厘米PfEMP1s或不表达双结合PfEMP1s的寄生虫与人脑微血管内皮细胞在单层培养。ICAM-1的特殊染色模式仅在A细胞周围观察到+厘米随着时间的推移,这些细胞系和内皮细胞的结合水平不断增加。
此外,内皮细胞的细胞膜与+厘米这些线显示出环形间隙,研究人员称之为环形/对接结构。他们的电子显微镜图像显示内皮细胞膜的变化;微绒毛向外延伸,一些周围的IRBC,最显著的是,在一些内皮细胞内可见完整的IRBC。当红细胞感染其他表达PfEMP1的寄生虫时,这些现象都没有出现。
两个实验支持这样的观点,即表达A组的IRBC的内化+厘米PfEMP1以ICAM-1和PfEMP1依赖的方式发生:
1) 内皮细胞与抗ICAM-1抗体预孵育可阻止a组的内化+厘米而与内皮细胞表面表达的另外两种分子的抗体孵育则没有。
2) 当IRBC最初与针对特异性ICAM-1结合DBLβ结构域产生的抗体孵育时,A组的内化+厘米感染细胞显著减少。
球体模型
内皮细胞、星形胶质细胞和周细胞将在培养物中自组装,形成血脑屏障的3D模型,其中星形胶质细胞在中心被周细胞和内皮细胞外层包围。
感染A组寄生虫的IRBC+厘米PfEMP1粘附在内皮层上,培养8小时后,一些细胞在球体内可见,并已迁移内皮细胞。与实验者第一次研究中使用的抗体预孵育抑制了这一点。
摄取实验表明,内皮细胞形成的通透性屏障被破坏,由于细胞肿胀,其体积增加。当感染了表达其他PfEMP1组的寄生虫的红细胞与球体一起孵育时,未观察到这些观察结果。
这个模型代表大脑吗?
然后,研究小组讨论了这些研究是否有趣的问题体外观察结果反映了一名脑型疟疾患者的大脑状况。对两例致命性脑疟疾患者的大脑进行的尸检分析显示,IRBC阻塞了血管。一些内皮细胞膜肿胀,存在疟疾色素,血吸虫素,这表明感染疟疾的红细胞在这里也发生了内化。
脑型疟疾病因的新假说?
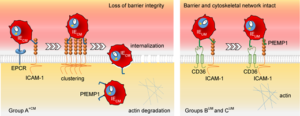
作者提出,内皮细胞上ICAM-1和EPCR受体的结合能力导致细胞表面ICAM-1受体聚集(在他们的实验中被视为对接位点)。然后触发内皮细胞吞噬这些IRBC。红细胞和寄生虫随后降解,释放毒素,包括血佐菌素。
到目前为止,尚不清楚血脑屏障完整性的丧失、IRBC的内化或其在脑微血管中的隔离和闭塞在多大程度上导致了脑疟疾的病理学。但是发现一个特定的PfEMP1蛋白家族的表达与所有这些病理学相关,这显然是我们理解疟疾寄生虫和脑细胞之间相互作用的一大步。

评论